من الأمثلة على الأحماض .. استخدامات الأحماض في الحياة
“من الأمثلة على الأحماض” .. الأحماض هي أحد أبرز العناصر الكيميائية التي تحيط بنا يومياً، حتى دون أن ندرك ذلك. تلك المواد الكيميائية الساحرة والقوية التي تتنوع في أشكالها واستخداماتها، تشكل جزءًا حاسمًا من عالمنا. فمنذ الأزل، لعبت الأحماض دورًا أساسيًا في حياتنا، وأصبح لدينا اليوم معرفة عميقة بأنواع متعددة منها.
هذه المقالة ستأخذك في جولة استكشافية لعالم الأحماض، حيث سنستكشف أمثلة مثيرة ومذهلة على دورها في حياتنا اليومية وفي عالم العلم والتكنولوجيا. ستتيح لك هذه الرحلة الاطلاع على جوانب جديدة ومذهلة من هذه المواد الكيميائية والتفاعلات الرائعة التي تقوم بها.
ما هي الاحماض؟
الأحماض هي مجموعة من المواد الكيميائية التي تمتلك خصائص مميزة. عمومًا، يمكن تعريف الأحماض بأنها مواد تتبرز بالتالي:
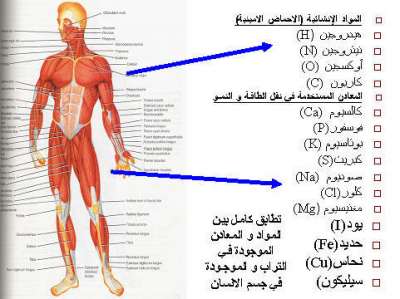
- تحتوي على ذرات هيدروجين (H): الأحماض تتكون من ذرات هيدروجين في هيكلها الجزيئي. هذه الذرات ترتبط بذرة هيدروجينية في الأحماض وتتفاعل بشكل مميز مع المواد الأخرى.
- تزيد من تركيز أيونات الهيدروجين (H+): عندما تذوب الأحماض في الماء، تزيد من تركيز أيونات الهيدروجين الموجبة (H+) في المحلول. هذا يجعلها تعمل كمواد حمضية.
هناك العديد من الأحماض المعروفة، بما في ذلك حمض الكبريتيك وحمض الهيدروكلوريك وحمض الستريك وحمض الأسيتيك، وكلها تختلف في تركيبها وخصائصها. يُستخدم الأحماض في مجموعة متنوعة من التطبيقات، بما في ذلك الصناعة، والكيمياء، والبيولوجيا، والطهي، والطب، والعديد من الصناعات الأخرى. تلعب الأحماض دورًا مهمًا في العالم اليومي وتعتبر أساسية في فهم الكيمياء والعلوم الطبيعية بشكل عام.
قد يهمك ايضاً : ما هي الكيمياء ؟
خصائص الاحماض
الأحماض لديها مجموعة من الخصائص المميزة التي تميزها عن مواد أخرى في مجال الكيمياء. إليك بعض الخصائص الرئيسية للأحماض:
- التفاعل مع المعادن: الأحماض تمتلك القدرة على التفاعل مع بعض المعادن لإنتاج غاز الهيدروجين وملح. على سبيل المثال، حينما تتفاعل حمض الهيدروكلوريك مع الزنك، يتم إطلاق غاز الهيدروجين وتكون كلوريد الزنك.
- التفاعل مع القواعد: الأحماض تتفاعل مع القواعد لتكوين ملح وماء. هذا التفاعل يسمى تفاعل التحيز الحمضي-القاعدي ويكون بموجب معادلات كيميائية محددة.
- خصائص الذوبان: العديد من الأحماض ذائبة في الماء، وعندما تذوب، تزيد من تركيز أيونات الهيدروجين الموجبة في المحلول، مما يجعل المحلول حمضيًا.
- التأثير على مؤشرات الحموضة: يمكن قياس درجة الحموضة باستخدام مقياس ال pH، والأحماض تكون دائمًا تحت pH 7، حيث أنها تزيد من تركيز أيونات الهيدروجين. كلما انخفض الرقم الذي يمثل قيمة pH، كلما زادت حموضة المحلول.
- تفاعل مع القواعد الأمينية: الأحماض يمكن أن تتفاعل مع المركبات التي تحتوي على مجموعات أمينية (-NH2) لتكوين أملاح عضوية معروفة باسم الأميدات.
- قوة الحمض: تختلف الأحماض في قوتها الحمضية، حيث تكون الأحماض القوية قادرة على إفراز عدد أكبر من أيونات الهيدروجين وتكوين محلول أكثر حموضة. على سبيل المثال، حمض الهيدروكلوريك هو حمض قوي.
- تأثير على الأصباغ: الأحماض قد تؤثر على الأصباغ بشكل ملحوظ، وهذا ما يمكن استخدامه في صناعة الألوان والصباغة.
هذه بعض الخصائص الرئيسية للأحماض، وتختلف هذه الخصائص من حمض إلى آخر حسب تركيبه وتركيزه.
من الأمثلة على الأحماض
هنا بعض الأمثلة على الأحماض المعروفة:
- حمض الهيدروكلوريك (HCl): هو حمض قوي يوجد في المعدة البشرية ويساهم في عملية الهضم. كما يستخدم في الصناعة الكيميائية وفي تنظيف المعادن.
- حمض الكبريتيك (H2SO4): يُعرف أيضًا بالكبريتيك، وهو واحد من أكثر الأحماض قوة وشيوعًا. يستخدم في العديد من التطبيقات الصناعية والكيميائية، بما في ذلك تصنيع الأسمدة والبطاريات.
- حمض النيتريك (HNO3): يُستخدم بشكل رئيسي في صناعة الأسمدة والمتفجرات، وهو حمض آخر ذو قوة عالية.
- حمض الستريك (C6H8O7): يُستخدم في صناعة الأغذية والمشروبات كعامل حافظ ومنكه. ويمكن أن يتواجد طبيعيًا في الفواكه مثل الليمون والبرتقال.
- حمض الأسيتيك (CH3COOH): يعرف أيضًا بحمض الخل ويتواجد في الخل الذي يُستخدم في الطهي والتخليل والتنظيف.
- حمض الهيالورونيك (Hyaluronic acid): هو حمض موجود طبيعيًا في الجسم البشري ويستخدم في منتجات العناية بالبشرة والعلاجات الطبية.
- حمض الأكساليك (C2H2O4): يُستخدم في تحلية المياه وإزالة الصدأ وفي عمليات تنظيف المعادن.
هذه أمثلة على بعض الأحماض المعروفة، وهناك العديد من الأحماض الأخرى ذات تركيبات واستخدامات متنوعة في العلوم والصناعة والحياة اليومية.
قد يهمك ايضاً : ادوات مخبرية كيميائية
استخدامات الأحماض في الحياة
الأحماض لها العديد من الاستخدامات في الحياة اليومية وفي مجموعة متنوعة من الصناعات. إليك بعض الاستخدامات الشائعة للأحماض:
- الهضم البشري: حمض الهيدروكلوريك في المعدة يساهم في عملية الهضم بتفتيت الطعام وقتل البكتيريا الضارة.
- الكيمياء: تُستخدم الأحماض في العديد من عمليات التفاعلات الكيميائية، مثل تحفيز التفاعلات الكيميائية وتنظيف المعادن.
- البطاريات: يُستخدم حمض الكبريتيك في بطاريات السيارات لإنتاج الكهرباء.
- الأسمدة: يتم استخدام حمض الكبريتيك وحمض النيتريك في صناعة الأسمدة لزيادة نمو النباتات.
- صناعة الأدوية: يتم استخدام الأحماض في تحضير الأدوية والمضادات الحيوية.
- العناية بالبشرة: حمض الهيالورونيك وحمض الأسكوربيك (فيتامين C) يُستخدمان في منتجات العناية بالبشرة.
- الصناعة الغذائية: حمض الأسيتيك (حمض الخل) يُستخدم في التخليل وإعطاء نكهة للأطعمة.
- تصنيع الألوان: الأحماض تستخدم في صناعة الأصباغ والألوان.
- تنظيف وتقليل الترسبات: تُستخدم الأحماض في تنظيف الأسطح وإزالة الصدأ والترسبات.
- التصوير والطباعة: يُستخدم الأسيتونيتريل في صناعة الأفلام الفوتوغرافية، وحمض السليكونيك في صناعة الحبر والطباعة.
- تصنيع المنتجات الصيدلانية: تُستخدم الأحماض في تصنيع الأدوية والفيتامينات.
- صناعة المواد البلاستيكية: الأحماض تُستخدم في إنتاج البلاستيك والألياف الصناعية.
- منظفات الزجاج والأسطح: تُستخدم الأحماض في تصنيع منظفات الزجاج ومنظفات الأسطح.
تُظهر هذه الأمثلة التنوع الهائل للاستخدامات التي تعتمد على الأحماض في مجموعة متنوعة من الصناعات والتطبيقات، مما يُظهر أهمية هذه المواد الكيميائية في حياتنا اليومية وفي التكنولوجيا الحديثة.
في الختام، يُظهر تنوع وشمول استخدامات الأحماض مدى أهميتها وأثرها في حياتنا اليومية وفي العلم والصناعة. هذه المواد الكيميائية البسيطة تلعب دورًا بارزًا في تحسين نوعية حياتنا وتقدم الحلاول للعديد من التحديات التقنية والصحية والبيئية.
قد يهمك ايضاً : الصيغ الكيميائية